1. आवर्त सारणी का परिचय
आवर्त सारणी क्या है
आवर्त सारणी, जिसे हम पीरियॉडिक टेबल के नाम से जानते हैं, रासायनिक तत्वों की एक व्यवस्थित तालिका है। इसे वैज्ञानिक दिमित्री मेंडलीव ने 1869 में बनाया था, जिसमें उन्होंने तत्वों को उनके परमाणु भार और गुणों के आधार पर क्रमबद्ध किया। आवर्त सारणी में सभी ज्ञात तत्वों को परमाणु क्रमांक, इलेक्ट्रॉन विन्यास और पुनरावृत्ति होने वाले रासायनिक गुणों के आधार पर वर्गीकृत किया गया है।
इस सारणी में तत्वों को 18 समूहों (ऊर्ध्वाधर) और 7 आवर्तों (क्षैतिज) में बांटा गया है। इसमें प्रत्येक तत्व का एक अद्वितीय स्थान होता है। जैसे ही हम सारणी में ऊपर से नीचे और बाएं से दाएं बढ़ते हैं, तत्वों का परमाणु क्रमांक बढ़ता है। आवर्त सारणी में धातु, अधातु और अर्ध-धातु तीन मुख्य श्रेणियों में तत्व बंटे हुए हैं। धातु तत्व बाईं ओर और अधातु तत्व दाईं ओर पाए जाते हैं।
आवर्त सारणी का विज्ञान और रसायन शास्त्र में अत्यधिक महत्व है क्योंकि यह तत्वों के गुणधर्मों की जानकारी और उनकी पुनरावृत्त प्रवृत्तियों को दर्शाती है। इसके माध्यम से वैज्ञानिक नए तत्वों की खोज कर सकते हैं और विभिन्न रासायनिक अभिक्रियाओं को बेहतर ढंग से समझ सकते हैं।

आवर्त सारणी का इतिहास
आवर्त सारणी का इतिहास 19वीं शताब्दी से शुरू होता है, जब वैज्ञानिकों ने तत्वों को व्यवस्थित करने की कोशिशें शुरू कीं। कई रसायनज्ञों ने तत्वों को उनके परमाणु भार और गुणों के आधार पर वर्गीकृत करने के प्रयास किए, लेकिन रूस के वैज्ञानिक दिमित्री मेंडलीव ने 1869 में इसे व्यवस्थित ढंग से प्रस्तुत किया।
मेंडलीव ने तत्वों को उनके बढ़ते हुए परमाणु भार के आधार पर एक सारणी में रखा और पाया कि कुछ तत्वों के रासायनिक गुणधर्म समय-समय पर दोहराते हैं। उन्होंने इसी “आवर्त नियम” का पालन करते हुए तत्वों को सारणी में इस तरह व्यवस्थित किया कि जिन तत्वों के गुणधर्म समान थे, वे एक ही समूह में आए। उन्होंने इस आवर्त सारणी में कुछ स्थान खाली छोड़े, ताकि भविष्य में खोजे जाने वाले तत्वों को उन स्थानों पर रखा जा सके।
मेंडलीव की भविष्यवाणियाँ सही साबित हुईं, और धीरे-धीरे अन्य वैज्ञानिकों ने भी इस सारणी को स्वीकार किया। आगे चलकर, परमाणु संरचना की खोज ने आवर्त सारणी के विकास में और सुधार किए। हेनरी मोसले ने 1913 में परमाणु क्रमांक की अवधारणा दी, जिससे सारणी को पुनः व्यवस्थित किया गया। इसके बाद, आधुनिक आवर्त सारणी का निर्माण हुआ, जिसमें 18 समूह और 7 आवर्त शामिल हैं, जो आज के समय में सभी ज्ञात तत्वों का समुचित प्रतिनिधित्व करती है।
2. आवर्त सारणी का संगठन
आधुनिक आवर्त सारणी का संगठन परमाणु क्रमांक, इलेक्ट्रॉनिक विन्यास और रासायनिक गुणधर्मों के आधार पर किया गया है। इस सारणी में 118 तत्व शामिल हैं, जिन्हें 18 ऊर्ध्वाधर स्तंभों (समूह) और 7 क्षैतिज पंक्तियों (आवर्त) में बाँटा गया है।
I. समूह (Groups):
- आवर्त सारणी में कुल 18 समूह होते हैं। प्रत्येक समूह में ऐसे तत्व होते हैं जिनके गुणधर्म समान होते हैं, क्योंकि उनके बाहरी कक्ष में इलेक्ट्रॉनों की संख्या समान होती है।
- समूह 1 को क्षारीय धातुएँ, समूह 2 को क्षारीय मृदा धातुएँ कहा जाता है। समूह 17 को हैलोजन और समूह 18 को नोबल गैसें कहा जाता है।
II. आवर्त (Periods):
- आवर्त सारणी में 7 आवर्त होते हैं। प्रत्येक आवर्त में तत्वों की परमाणु संख्या बढ़ती जाती है।
- पहले आवर्त में 2 तत्व होते हैं, जबकि दूसरे और तीसरे में 8-8 तत्व होते हैं। चौथे और पाँचवे आवर्त में 18-18 तत्व होते हैं, और छठे व सातवें में 32-32 तत्व शामिल होते हैं।
III. धातु, अधातु और अर्ध-धातु:
आवर्त सारणी में तत्वों को उनके भौतिक और रासायनिक गुणों के आधार पर धातु, अधातु, और अर्ध-धातु में विभाजित किया गया है। बाईं ओर धातु, दाईं ओर अधातु, और बीच में अर्ध-धातु पाए जाते हैं।
IV. लैंथेनाइड और ऐक्टिनाइड:
यह तत्व नीचे की दो पंक्तियों में रखे गए हैं और आवर्त सारणी के भीतर आवर्त 6 और 7 के अंतर्गत आते हैं।
3. परमाणु संरचना और तत्वों की विशेषताएँ
परमाणु संरचना:
परमाणु वह कण है जो किसी तत्व का मूलभूत हिस्सा होता है। परमाणु की संरचना तीन प्रमुख कणों से मिलकर बनती है:
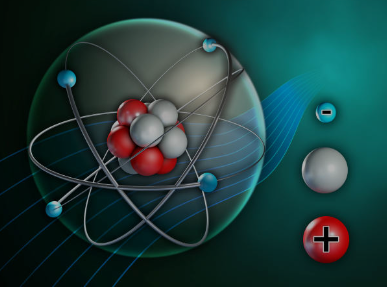
I. प्रोटॉन (Proton):
- प्रोटॉन का द्रव्यमान लगभग 1 अमू (atomic mass unit, amu) होता है।
- प्रोटॉन का विद्युत आवेश सकारात्मक (+) होता है।
- यह परमाणु के केंद्र, न्यूक्लियस में स्थित होता है।
II. न्यूट्रॉन (Neutron):
- न्यूट्रॉन का द्रव्यमान भी लगभग 1 अमू होता है।
- इसका विद्युत आवेश निराकार (neutral) होता है, अर्थात इसका कोई आवेश नहीं होता।
- न्यूट्रॉन भी प्रोटॉन के साथ न्यूक्लियस में स्थित होता है।
III. इलेक्ट्रॉन (Electron):
- इलेक्ट्रॉन का द्रव्यमान बहुत कम होता है (लगभग 1/1836 अमू)।
- इसका विद्युत आवेश नकारात्मक (-) होता है।
- इलेक्ट्रॉन परमाणु के बाहर, परमाणु आवरण (electron shell) में घूमते हैं।
IV. परमाणु की संरचना का सारांश:
- परमाणु का केंद्रीय हिस्सा न्यूक्लियस कहलाता है, जिसमें प्रोटॉन और न्यूट्रॉन होते हैं।
- परमाणु के चारों ओर इलेक्ट्रॉन विभिन्न ऊर्जा स्तरों (shells) में स्थित होते हैं।
तत्वों की विशेषताएँ:
I. परमाणु संख्या (Atomic Number):
- यह किसी तत्व के परमाणु में उपस्थित प्रोटॉनों की संख्या होती है। यह तत्व की पहचान करती है।
- उदाहरण: हाइड्रोजन का परमाणु संख्या 1 है, इसका मतलब है कि हाइड्रोजन के परमाणु में 1 प्रोटॉन होता है।
II. आयनन संख्या (Mass Number):
- यह किसी तत्व के परमाणु में प्रोटॉनों और न्यूट्रॉनों की कुल संख्या होती है।
- उदाहरण: कार्बन-12 में 6 प्रोटॉन और 6 न्यूट्रॉन होते हैं, तो इसकी आयनन संख्या 12 होती है।
III. इलेक्ट्रॉनिक संरचना (Electronic Configuration):
- यह दर्शाती है कि किसी तत्व के इलेक्ट्रॉन किस-किन आवरणों में स्थित होते हैं।
- उदाहरण: ऑक्सीजन (O) का इलेक्ट्रॉनिक संरचना 2,6 होती है, यानी इसके पहले आवरण में 2 इलेक्ट्रॉन और दूसरे में 6 इलेक्ट्रॉन होते हैं।
4. आवर्त सारणी के समूह
आवर्त सारणी के समूह (Groups) को समझना बहुत महत्वपूर्ण है क्योंकि ये तत्वों के रासायनिक गुणों और व्यवहार को निर्धारित करते हैं। आवर्त सारणी में कुल 18 समूह होते हैं, जो प्रत्येक कॉलम (vertical column) को दर्शाते हैं। हर समूह में एक जैसे रासायनिक गुण होते हैं क्योंकि उनके बाहरी इलेक्ट्रॉन की संख्या समान होती है। चलिए, हम इसे सरल भाषा में समझते हैं:
I. समूह 1 - क्षारीय धातुएं (Alkali Metals):
- तत्व: लिथियम (Li), सोडियम (Na), पोटेशियम (K), रूबिडियम (Rb), सीसियम (Cs), फ्रेंशियम (Fr)
- गुण:
- ये तत्व बहुत प्रतिक्रियाशील होते हैं और पानी से प्रतिक्रिया करते हैं, जिससे हाइड्रोजन गैस और क्षारीय समाधान बनता है।
- इनका बाहरी इलेक्ट्रॉन एक होता है।
- ये मुलायम और हल्के होते हैं।
II. समूह 2 - क्षारीय पृथ्वी धातुएं (Alkaline Earth Metals):
- तत्व: बेरेलियम (Be), मैग्नीशियम (Mg), कैल्शियम (Ca), स्ट्रोंटियम (Sr), बैरियम (Ba), रेडियम (Ra)
- गुण:
- ये तत्व भी प्रतिक्रियाशील होते हैं लेकिन समूह 1 के तत्वों से कम।
- इनका बाहरी इलेक्ट्रॉन दो होते हैं।
- ये धातुएं ज्यादा कठोर होती हैं।
III. समूह 3-12 - संक्रमण धातुएं (Transition Metals):
- तत्व: लोहा (Fe), तांबा (Cu), चांदी (Ag), सोना (Au), प्लेटिनम (Pt)
- गुण:
- ये धातुएं मजबूत, कठोर और चमकीली होती हैं।
- इनका उपयोग उद्योगों में किया जाता है (जैसे लोहा, तांबा, चांदी)।
- इनकी रासायनिक प्रतिक्रियाएँ और संयोजन विविध होते हैं।
समूह 13 - बोर समूह (Boron Group):
- तत्व: बोरॉन (B), ऐल्यूमीनियम (Al), गैलियम (Ga), इंडियम (In), थलियम (Tl)
- गुण:
- इन तत्वों में तीन बाहरी इलेक्ट्रॉन होते हैं।
- ऐल्यूमीनियम और गैलियम का उपयोग महत्वपूर्ण धातुओं में किया जाता है।
- ये कुछ रासायनिक प्रतिक्रिया करते हैं, लेकिन इनकी प्रतिक्रियाशीलता बहुत ज्यादा नहीं होती।
V. समूह 14 - कार्बन समूह (Carbon Group)
- तत्व: कार्बन (C), सिलिकॉन (Si), जर्मेनियम (Ge), टिन (Sn), सीसा (Pb)
- गुण:
- इन तत्वों में चार बाहरी इलेक्ट्रॉन होते हैं।
- कार्बन जीवन के लिए आवश्यक तत्व है (जैसे जैविक यौगिक)।
- सिलिकॉन का उपयोग इलेक्ट्रॉनिक्स में होता है।
VI. समूह 15 - नाइट्रोजन समूह (Nitrogen Group)
- तत्व: नाइट्रोजन (N), फास्फोरस (P), आर्सेनिक (As), एंटिमनी (Sb), बिस्मथ (Bi)
- गुण:
- इन तत्वों में पांच बाहरी इलेक्ट्रॉन होते हैं।
- नाइट्रोजन गैस के रूप में वातावरण में बहुतायत में पाया जाता है।
- इनका उपयोग कृषि (जैसे उर्वरक) और उद्योग में होता है।
VII. समूह 16 - ऑक्सीजन समूह (Oxygen Group):
- तत्व: ऑक्सीजन (O), सल्फर (S), सेलेनियम (Se), टेल्यूरियम (Te), पोलोनियम (Po)
- गुण:
- इन तत्वों में छह बाहरी इलेक्ट्रॉन होते हैं।
- ऑक्सीजन जीवन के लिए आवश्यक है, और सल्फर का उपयोग उद्योगों में होता है।
- ये तत्व बहुत प्रतिक्रियाशील होते हैं और कई रासायनिक प्रतिक्रियाओं में भाग लेते हैं।
VIII. समूह 17 - हैलोजन (Halogens):
- तत्व: फ्लोरीन (F), क्लोरीन (Cl), ब्रोमिन (Br), आयोडिन (I), एस्टेटिन (At)
- गुण:
- इन तत्वों में सात बाहरी इलेक्ट्रॉन होते हैं।
- ये अत्यधिक प्रतिक्रियाशील होते हैं और बहुत सारे यौगिक बनाते हैं।
- इनका उपयोग पानी को शुद्ध करने, बैक्टीरिया को मारने, आदि में होता है।
IX समूह 18 - आदर्श गैसें (Noble Gases):
- तत्व: हीलियम (He), नेऑन (Ne), आर्गन (Ar), क्रिप्टोन (Kr), ज़ेनॉन (Xe), रेडोन (Rn)
- गुण:
- इन तत्वों में आठ बाहरी इलेक्ट्रॉन होते हैं (यह पूर्ण आवरण होता है)।
- ये तत्व रासायनिक रूप से निष्क्रिय होते हैं और बहुत कम संयोजन करते हैं।
- इनका उपयोग लाइटिंग (जैसे नेऑन लाइट) और चिकित्सा उपकरणों में होता है।
समूहों का महत्व:
- रासायनिक गुण: हर समूह के तत्वों के रासायनिक गुण समान होते हैं, क्योंकि इनके बाहरी इलेक्ट्रॉन की संख्या समान होती है।
- प्रतिक्रियाशीलता: समूह 1 और 17 के तत्व अधिक प्रतिक्रियाशील होते हैं, जबकि समूह 18 के तत्व निष्क्रिय होते हैं।
- आवेदन: विभिन्न समूहों के तत्वों का उपयोग विभिन्न उद्योगों और जीवन के विभिन्न क्षेत्रों में किया जाता है, जैसे निर्माण, चिकित्सा, कृषि, और ऊर्जा।
इस प्रकार, आवर्त सारणी के समूहों के अध्ययन से हमें तत्वों के रासायनिक गुणों, उनके उपयोग और उनके बीच के संबंधों को समझने में मदद मिलती है।

